ژن درمانی
مقدمه
كه آياميتوان با ايجاد تغييراتي در آن به جنگ بيماريها رفت.اكنون پس از گذشت حدود پنج دهه به نظر مي رسد كه اين هدف در دسترس دانشمندان قرار گرفته است. بسياري از بيماريهاي انسان همچون هموفيلي ، تالاسمي ، كم خوني داسي شكل ، فاويسم ، نقص ايمني شديد مركب (( Scid و… ريشه در اختلالات ژنتيكي دارند در اين بيماريها يك ژن خاصي كه پروتئين ويژه اي را رمز مي كند ، دچار جهش شده و به خوبي عمل نمي كند براي مثال بيماران مبتلا به نقص ايمني شديد مركب داراي نقص ژن توليد كننده آنزيم آدنوزين دآميناز ADA هستند.)) غياب اين آنزيم موجب تجمع دزوكسي آدنوزين تري فسفات مي شود كه براي لنفوسيتها سمي است وموجب مرگ زود رس آنها مي شود ، لنفوسيتها مهمترين سلولهاي سيستم ايمني هستند وبا مرگ آنها سيستم ايمني سلولي دچارتضعيف شديد مي شود. بيماران مبتلا به در اثر نقص در ايمني سلولي وخوني به عفونت هاي مكرر و تهديد كننده رندگي دچار شده ومعمولا در همان دوران بچگي جان خود را از دست مي دهند . در بيماري هاي هموفيلي نيز ژن توليد كننده يك فاكتور خوني موثر در فرايند انعقاد دچار نقص است وبنابراين افراد مبتلا دچار مشكل انعقادي هستند، تلاشهاي زيادي براي انتقال نسخه سالمي از اين ژنهاي معيوب به سلولهاي افراد مبتلا صورت گرفته ونتايج مثبتي نيز به دست آمده است ولي هنوز تا باليني شدن اين روش درماني راه درازي در پيش است . در واقع ژن درماني هنوز در مرحله مطالعات است وهر مورد ژن درماني نيز هزينه بسيار سنگيني را در بر خواهد داشت ولي با اين حال با توجه به اهميت آن شركتهاي بزرگي در سطح جهان سرمايه گذاريهاي سنگين در اين بخش كرده اند وژن درماني كم كم درحال واقعيت پيدا كردن است.
ژن درمانی
بیماریهای ژنتیکی را میتوان در سطوح متعدد ، در مراحل گوناگون دور از ژن جهش یافته درمان کرد. فناوری DNA نو ترکیب ، مد نظر قرار دادن بیماریهای ژنتیکی در بنیادیترین سطح ، یعنی ژن را امکان پذیر کرده است. یکی از این روشهای درمانی ، ژن درمانی است. هدف از ژن درمانی ، بهبود بخشیدن به سلامت بیمار از طریق اصلاح فنوتیپ جهش یافته است. برای این منظور ، تحویل ژن طبیعی به سلولهای پیکری (نه زاینده) لازم است. وارد کردن یک ژن به داخل سلولهای پیکری ممکن است به 3 منظور لازم باشد.
• امکان دارد، ژن درمانی قادر به جبران کردن یک ژن جهش یافته سلولی که نوعی جهش از دست دهنده عملکرد دارد، بکار برود. مثلا برای درمان بیماری مغلوب اتوزومی فنیل کتونوریا.
• میتوان ژن درمانی را برای جایگزینی یا غیر فعال کردن یک ژن جهش یافته غالب که فرآورده غیر طبیعی آن موجب بیماری میشود انجام داد مانند بیماری هانتیگتون.
• گستردهترین کاربرد احتمالی ژن درمانی در رسیدن به اثری فارماکولوژیک ، جهت مقابله با آثار یک ژن یا ژنهای جهش یافته سلولی یا مقابله با ایجاد بیماری به طریق دیگر باشد. مبتلایان به بیماری اکتسابی از جمله سرطان، از این روش بهره میبرند.
حداقل شرایط لازم برای ژن درمانی اختلال ژنتیکی
• بار قابل توجه تبادل توجه بیماری و نسبت مطلوب خطر.
• داشتن فایده در مقایسه با درمانهای دیگر.
• آگاهی کافی از اساس مولکولی بیماری.
• اجزای تنظیم کننده مناسب برای ژن انتقال یافته.
• یک سلول هدف مناسب با نیمه عمر ترجیحا طولانی یا قابلیت همانند سازی خوب در داخل بدن.
• اطلاعات کافی از مطالعات سلولهای کشت داده شده.
خصوصیات ژن انتقال یافته
خصوصیات سلول هدف
روشهای انتقال ژن
وارد کردن ژن به داخل سلولهای کشت داده شده از بیمار در خارج بدن و سپس وارد کردن سلولها به بدن بیمار پس از انتقال ژن است.
روش دوم
روش دوم ، تزریق کردن مستقیم ژن به داخل بافت یا مایع خارج سلولی مورد نظر از طریق ناقلهای ویروسی و ناقلهای غیر ویروسی است. فناوری ناقلهای غیر ویروسی ، هنوز در مراحل مقدماتی است.
ناقلهای ویروسی
ناقلهای غیر ویروسی
• DNA برهنه ، مثلا DNA مکمل با عناصر تنظیم کننده در پلاسمید.
• DNA برهنه ، بسته بندی شده در لیپوزمها.
• پروتئین که در آن DNA با پروتئینی مجموعه تشکیل میدهد و این پروتئین ورود مجموعه به داخل سلول یا بخشهای اجزای سلولی را تسهیل میکند.
• کروموزومهای مصنوعی.
مخاطرات ژن درمانی
• ژن انتقال یافته در DNA بیمار جای میگیرند و پروتوانکوژنی را فعال یا یک ژن سرکوب کننده تومور را غیر فعال میکند که موجب بدخیمی میشود.
• فعال شدن درجی میتواند انسجام یک ژن ضروری را از بین ببرند.
بیماریهای نامزد ژن درمانی
تعداد زیادی کارآزمایی بالینی برای ارزیابی بیخطر بودن و کارآیی درمان با انتقال ژن در دست انجام است. نتایج اصلی میزگرد سال 1995 موسسه ملی سلامت در مورد وضعیت و آینده ژن درمانی هنوز صادق است. پیشرفت در این زمینه آهسته بوده. تاکید تحقیقات همواره مناسب نبوده وادعاهای اولیه در مورد کارآیی آن مبالغه آمیز بوده است. با وجود این ، میزگرد به این نتیجه رسید که ژن درمانی برای درمان بیماریهای انسانی در دراز مدت ، بسیار امیدوار کننده است.
1-مفهوم وفايده ژن درماني چيست؟
بنا به تعريف ژن درماني يك استراتژي درماني است كه شامل وارد كردن اسيدهاي نوكلئيك به سلولهاي انساني براي دستيابي به اهداف درماني است بنابراين اسيد نوكلئيك به عنوان دارو عمل مي كند اين روش دردرمان برخي بيماريهاوجلوگيري از
انتقال آنها به نسل بعد موثر است .
2-موانعي كه برسر راه آن وجود دارد چيست ؟
موانع ومشكلاتي در مورد ژن درماني سلولهاي جنسي وجود داردكه موجب مي شود اين روش فعلا در مطالعات باليني وارد نشود مهمترين موانع اين روش خطرات احتمالي براي جنين ((مثل احتمال ايجاد سرطان در صورت قرار گرفتن ژن مورد انتقال در ناحيه يك ژن عملكردي يا تنظيمي )) تغيير گنجينه ژنتيكي انسان و خطرات اجتماعي و مسئله اصلاح نژادي ((eugenics )) است .
3-ژن درماني در آينده به چه صورت خواهد بود ؟
بيماريهايي مانند سندرم ((Leshnyhan )) ، كه بيماري دردناكي است و درآن بيماران قادر به ساختن آنزيم خاصي در بدنشان نيستند ، جزو بيماريهاي نادري هستند كه در آينده درجدول ژن درماني قرار خواهند گرفت .اين بيماري باعث حالت عجيبي براي مجروح كردن وكندن اعضاي بدن در بيمار مي گردد ، مثل گاز گرفتن شديد لب ها و انگشتان . در حال حاضر حالت عادي ژن معيوب در اين بيماري شناسايي شده است.
قبل از اين كه درمان بيماري ژنتيكي بتواند قابل اجرا گردد عيب و نقص ژنتيكي بايد به طور دقيق شناسايي گردد دراين جا است كه علم(( biotechnology )) به احتمال زياد اثر قابل توجهي در آينده بسيار نزديك خواهد داشت. بررسي در مهندسي ژنتيك ابزار قدرتمندي را براي پيدا كردن اينجا ومكان ايجاد كرده است .
4-توضيحي درمورد وقتي كه somatic versus germ cells هدف قرار گرفته اند بيان كنيد ؟
يكي از اين بيماري ها pheny lketonuria است كه به صورت مخففpku نوشته مي شود از هر 12000 بچه سفيد پوست يك نفربه اين بيماري مبتلا است ودرصورت عدم رسيدگي به موقع مي تواند منجر به بيماري رواني گردد .اين بيماري به وسيله اختلال در ژني كه آنزيم كبدي توليدمي كند ، ايجادمي گردد.چنانچه اين نقص درمراحل اوليه باشد، بچه را مي توان براي چند سال تحت رژيم خاصي قرار داد كه البته كار بسيار ناخوشايندي است و اعضاي خانواده را دچار مشكلات بسيار مي كند .
روش هاي مختلف ژن درماني همگي عامل مشتركي دارند يعني بافت هاي تحت درمانsomatic هستند. در مقام مقايسه جايگزين كردن سلول هاي معيوب در سلولهاي germ line كه به ژنتيك ارثي نونهالان كمك مي كند بهتر است ژن درماني در سلولهاي germ line نه تنها بر شخص تحت درمان كه بر بچه هاي او نيز اثر بخشي زيادي دارد grem line درماني مسائل ژنتيكي تمام بشريت را دگرگون خواهد كرد ونسل هاي آينده بايد با آن دگرگوني وتحول خو بگيرند .
5- اهميت ژن درماني را بيان كنيد ؟
در بيماري هاي به اصطلاح متابوليكي ،ژنتيكي كه به آن توجه بسياري شده،ژن معيوبي باعث مي گردد،تا آنزيمي درعملكرد متابوليكي خاص خود يا حضور نداشته باشد و يا بلااثر باشد.
قدم موثردردرمان نارسايي هاي ژنتيكي درانسان،ژن درماني است.اين روشي است كه در آن ژن به جاي ژن معيوب ياغائب ،ژن فعالي جايگزين مي گردد به اين ترتيب بدن قادربه ساختن آنزيم يا پروتئين كامل شده ودر نتيجه ريشه بيماري خشك ميشود.
6-درمورد چندين مورد موفق ژن درماني مفصل توضيح دهيد؟
عموما اسيد نوكلوئيك مورد استفاده در ژن درماني يك DNA دو رشته اي است كه يك پروتئين نشانگر ( ( MARK ER )) ، مخرب ( ( ( ( DESTRUCTIVEيا درماني را رمزميكند.
پروتئين هاي نشانگر يا مخرب معمولا در درمان سرطان به كار ميروند براي مثال در يك روش درماني ژن رمز كننده آنزيم تيميدين كينازهرپس ويروس (( ويروس عامل تبخال )) وارد سلولهاي توموري ميگردداين ژن در منطقه توموري بيان شده وآنزيم تيميدين كيناز را توليد مي كند سپس به فرد داروي گان سيكلو و ير را مي دهند آنزيم تيميدين كيناز ،گان سيكلووير را به يك ماده سمي و كشنده سلولي تبديل مي كنند و از آنجاكه اين آنزيم فقط وارد سلولهاي توموري شده است ماده سمي ايجاد شده نيز فقط در ناحيه توموري ايجادو موجب مرگ سلولهاي توموري ميشود منظور از پروتئينهاي درماني نيزپروتئين- هايي است كه خود در بدن نقش مهمي ايفا مي كنند و بنابر دلايل مختلف د ر بيماران داراي نقص ژنتيكي دچار نقص هستند يا وجود ندارند هموفيلي ، تالاسمي ،وبسياري از بيماريهاي ديگر دراين گروه قرار مي گيرند و در ژن درماني از آنهانسخه سالمي از ژن توليد كننده پروتئين مورد نظر وارد بدن بيمار مي گردد .
اسيد نوكلوئيك همچنين مي تواند Antisense RNA يا DNA تك رشته اي باشد . در اين استراتژي درماني قطعهاي كوچك از RNA يا DNAتك رشته اي كه دقيقا مكمل راه انداز ژن يا بخشي از توالي موجود در ژن است در آزمايشگاه ساخته شده و به بدن بيمارمنتقل مي گردد اين قطعه كه Antisense ناميده مي شود به توالي مورد نظر متصل شده ومانع رونويسي ژن وتوليد پروتئين مرتبط با آن مي شود اين نوع ژن درماني نيزمعمولا دردرمان سرطان كاربرد دارد وبا استفاده ازاين قطعات اسيد نوكلئيك از توليد پروتئين هاي موثر در فرايند سرطان جلوگيري به عمل مي آيد. همچنين از اين روش در درمان بيماري هاي ژنتيكي غالب (مثل بيماري هانتينگتون) استفاده مي شود.
اولين كارآزمايي هاي باليني در سال 1990 وبراي درمان بيماري نقص ايمني مركب شديد( SCID ) انجام شد ،اين بيماري اتوزومي مغلوب است كه به علت نقص آنزيم آدنوزين دآميناز (ADA) ايجاد مي شود غياب اين آنزيم ، موجب تجمع دزوكسي آدنوزين تري فسفات مي شودكه براي لنفوسيت ها سمي است ومرگ زود رس آنها را موجب ميشود .بيماران مبتلا دراثر نقص در ايمني سلولي وخوني ،به عفونت هاي مكرر وتهديد كننده زندگي دچار شده ومعمولا درهمان دوران بچگي جان خود را از دست مي دهند.
بلاز و همكارانش، لنفوسيت هاي گردش خون دو بيمار را خارج كرده ، كشت داده وآنها را بارترو ويروس حامل ژن (ADA ) آلوده كردند وسپس اين سلولها رامجددا به بيماران تزريق كردند .
در يكي از دو بيمار، لنفوسيتهاي T انتقال داده شده ،مدت زمان طولاني دوام آوردند و علايم بيماري وي بهبود يافت وسالها پس از درمان ،زندگي طبيعي خود را سپري مي كند.
7-تاثير موفقيت ژن درماني را روي صنايع داروسازي بيان كنيد؟
حساس كردن سلولهاي توموري به شيمي درماني وپرتو درماني يكي از روشهاي مهم ژن درماني سرطان مي باشد برخي ژن ها مي توانند به طور مستقيم اثر بخشي ديگر درمان ها را از طريق ايجاد تغييراتي در ترميم DNA ، سيستم هاي انتقال پيام سلولي (SIGNALTRANSDUCTION )يا كنترل چرخه سلولي را افزايش دهند . براي مثال مطالعات نشان داده اند كه جايگزين كردن يك ژن سركوب كننده تومور P53 ميتواند به افزايش حساسيت سلول هاي توموري به داروي سيس پلاتين و ساير داروها منجر گردد برخي ژن ها نيز با توليد يك آنزيم كه به طور انتخابي و موضعي يك داروي غير سمي را به متابوليت بسيار سمي در سلولهاي سرطان تبديل مي كند مي توانند مرگ سلول را باعث شوند .اين روش مي تواند عوارض شيمي درماني را به طرز چشمگيري كاهش دهد. ژن تيميدين كيناز هرپس ويروس ((HSV-TK )) يكي از آنزيم هايي است كه بسيار مورد مطالعه قرار گرفته است .فراورده اين ژن يعني تيميدين كيناز موجب فسفريله كردن گان-سيكلووير و تبديل آن به شكل مونو فسفات سمي مي شود ،گان سيكلوويريك داروي ضد ويروس است كه به خودي خود اثري روي سلول نمي گذارد اما متابوليت هاي فسفريله آن براي سلول كشنده خواهد بود . سلول هاي انساني فاقد آنزيم لازم براي فسفريله كردن اين دارو هستند ( لازم به ذكر ا ست مونو فسفات در اين مرحله طي تغييراتي توسط آنزيم هاي داخل سلولي تبديل به تري فسفات سمي مي شود .)
ابزار و اهداف كشف داروها :
در توسعه درمانها گشوده است. موسسه هايي مانند ريبوزيمز و RNA به صورت فوري به عنوان استراتژي موثر در باب ژنهاي آرام و تكنيك هاي جديد در حال توسعه اند .براي بكار گيري RNA با دارايي و كاراييهاي مخصوص ، هدف گرفتن RNA با سلول هاي كوچك به عنوان يك دسترسي جالب براي مدرنه كردن وجود RNA به كار برده مي شود . دارايي هاي يونيك شيميايي و بيولوژيك RNA موقعيت هاي بسياري مناسبي را دركشف داروها براي جلوگيري از نشانه رفتن پروتئينها به ما ميدهند اين خاصيت باعث تحقيق درموقعيت هايي كه در بالا ذكر شد و نمايان كردن خاصيت درمان RNA مي شود .
8- وضعيت ژن درماني را در آينده پيش بيني كنيد؟
نقش ويروس AAV در بيوتكنولوژي و ژن درماني
اولين وعدة زيست فناوري (بيوتكنولوژي) جداكردن و توليد اين پروتئينها از طريق مهندسي ژنتيك و فناوري نوتركيبي بود تا آنها را در اختيار بيماراني قراردهد كه فاقد آن پروتئينها بود. حال اگر اين پروتئينها بهصورت داروهاي خوراكي استفاده ميشد هضم شده و بي اثر ميگشت. برخي از محصولات به وسيله تزريق به بدن ميرسيد، تزريقهاي مكرري كه روزانه، هفتگي يا ماهيانه يا توسط خود بيمار انجام ميشد(مثل انسولين) يا توسط پزشك. اما اين كارهم خالي از اشكال نبود، زيرا بسيار سخت است كه سطح مناسبي از دارو( پروتئين ) را در فواصل بين تزريقها برقراركرد. از طرفي برخي سلولها نظير سلولهاي مغزي به علت وجود سد خوني مغزي ( BBB ) ممكن است نتوانند مقدار مناسبي از دارو را دريافت كند.
با ظهور ژن درماني اميدهاي تازه اي براي اين بيماران فراهم شده است. ژن درماني تحويل خودِ پروتئينِ درماني نيست بلكه ژن آن پروتئين را تحويل بيمار ميدهد. اين ژن وارد سلولهاي بدن شده و آنها را به كارخانههاي كوچكي تبديل ميكند كه پروتئين موردنياز بيمار را تا مدتي طولاني برايش ميسازد.
همچنين با استفاده از ژن درماني اقدام به درمان سرطان كردهاند زيرا برخي ژنها باعث ميشود كه سلولهاي سرطاني پروتئين خاصي را بيان كند كه به داروها حساستر شده يا توسط سلولهاي ايمني بهتر شناسايي شود. اين استراتژي باعث ميشود كه شيمي درماني يا پاسخ ايمني خودِ بيمار، موثرتر عمل كند.
براي انتقال ژن درمان كننده از روشهاي مختلفي استفاده ميشود. ازجمله تزريق فيزيكي توسط ميكرواينجكشن، انتقال توسط ليپوزومها، و انتقال توسط ويروسها كه مورد اخير موضوع بحث ما است. در انتقال ويروسي از ويروسهاي مختلف نظير رترو ويروسها، آدنو ويروسها، لنتي ويروسها، هرپس ويروسها و AAV ويروسها (Adeno-Associated Virus) استفاده ميشود.
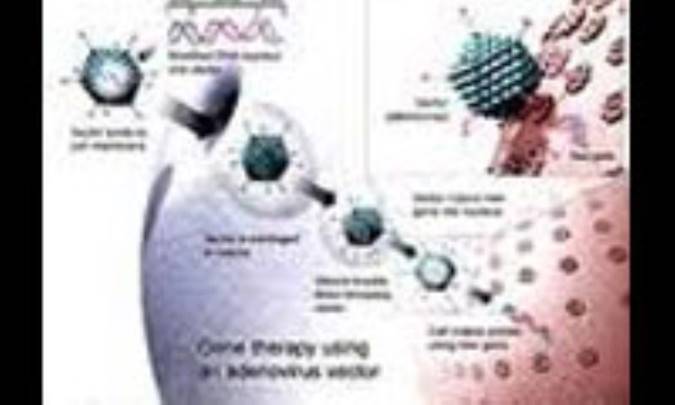
در روش استفاده از ويروسِ AAV ، همانطوري كه در شكل (1) نشان داده شده است. ژنهاي ويروس از يك ويروس بي خطر به نام "AAV ويروس" خارج شده و سپس ژنِ درمان كننده بهجاي آن جايگزين ميشود. بعد از تزريق اين ويروسها به بيمار "AAV ويروس ها" ميتواند ژنِ درمان كننده را به سلولها انتقال دهد. حال پروتئين موردنياز توسط سلولهاي خودِ بيمار ساخته خواهد شد، همانگونه كه اگر خود سلول DNA مربوطه را ميداشت عمل ميكرد. اين پروتئين يا وارد غشاء سلول ميشود تا مورد استفادة خود سلول قرارگيرد يا توسط سلول ترشح ميشود كه مورد استفادة سلولهاي ديگر قرارگيرد.
ويروس AAV (Adeno-Associated Virus)
وكتورهاي AAV
DNA متعلق به "AAV ويروس" تك رشتهاي است و فقط شامل 2 ژن است. يكي به نام ژن Rep كه پروتئينهاي مربوط به همانندسازي DNA را كد ميكند و ديگري به نام ژن Cap كه از اسپلايسينگ افتراقي استفاده ميكند و اجازه ميدهد كه سه پروتئين را كد كند كه پروتئينهاي پوشش(coat) ويروس را ميسازد.
با استفاده از اين روش در حالي كه هيچ كدام از ژنهاي ويروسي وجود ندارد اتصال سلولي كارا و ساز و كار ورود ژن بوسيلة پروتئين پوششي "AAV ويروس" مهيا ميشود. فقط قسمتي كوچكي از DNA متعلق به AAV در طرفين اين قطعة ژني درمان كننده در وكتور باقي ميماند كه حاوي قطعات خودكامل شونده DNA ملقب به ITR ها (Inverted Terminal Repeats ) است و اين ژنها براي تامين سطح بالايي از بيانِ ژنِ درمان كنندهاي كه وكتور آن را حمل ميكند، لازم است.
هر وكتور AAV فقط از 4 نوع مولكول تشكيل شده است. سه وكتور، دقيقاً در ارتباط با پروتئينهايي است كه پوشش ويروس را ميسازد و يك قطعة تك رشته اي DNA ژن درمان كننده و ديگر عناصر تنظيم كننده را كد ميكند.
سادگي اين سيستم باعث ميشود كه گيرندگان وكتورهاي AAV در معرض حداقل مقدار مواد خارجي (بيگانه) قرار گيرند. در مقابل ديگر وكتورهاي ويروسي كه براي ژن تراپي استفاده ميشود، مانند آنهايي كه با استفاده از آدنو ويروسها، لنتي ويروسها، رترو ويروسها، و هرپس ويروسها درست شدهاند، بهطور بارزي بزرگتر و پيچيدهتر است و بنابراين احتمال آن كه به پاسخ ايمني منجر شده و واكنشهاي زيان آوري را براي استفاده هاي بعدي درپي داشته باشد، بسيار بيشتر است.
عقيده بر اين است كه وكتورهاي AAV خواص مطلوب وكتورهاي ويروسي و وكتورهاي غير ويروسي را تركيب ميكند و ممكن است نسبت به ديگر وكتورهاي ژن درماني چندين مزيت بالقوة ارائه دهد. اين مزايا عبارتند از:
* تحويل موثر ژنها به هر دو نوع سلول هدف در حال تقسيم و آنهايي كه تقسيم نمي شود،
* عدم حضور ژنهاي ويروسي كه ميتواند مسؤول ايجاد پاسخ ايمني ناخواسته باشد،
* كاربرد in-vivo در بيماران،
* ميزان بالاي بيان ژن و
*پايداري عالي كه اجازه ميدهد وكتورهاي AAV همانند بيشتر محصولات دارويي رايج توليد و ذخيره شده و مورد استفاده قرار گيرد.
شكل (1): شماتيك مراحل ژن درماني با AAV
شكل (2)AAV زير ميكروسكپ الكتروني
شكل (3): ساختمان ژني DNA ويروس AAV
منابع:
-http://www.accessexcellence/
- http://www.goftman.com/forums/history/topic/17689-l.html
- مجله الکترونیکی ژنتیک پزشکی
- غفاری, سعید رضا, ژنتیک برای کارشناسان نظام سلامت, تهران" انتشارات اندیشه سرا, ۱۳۸۵
ارسال مقاله توسط کاربر محترم سايت : hojat20


























